Cục Quản lý dược (Bộ Y tế) đã có văn bản gửi Sở Y tế các tỉnh thành, các cơ sở nhập khẩu thuốc yêu cầu thu hồi 11 loại thuốc điều trị viêm loét dạ dày, tá tràng, ruột chứa hoạt chất Ranitidine có tạp chất NDMA vượt giới hạn cho phép.
Theo quy định tại ICH M7 thì giới hạn NDMA tạm thời chấp nhận không quá 0.32 ppm (tính trên liều chấp nhận tối đa của NDMA là 96 nanogram/ngày và liều sử dụng tối đa của Ranitidine là 300 mg/ngày).
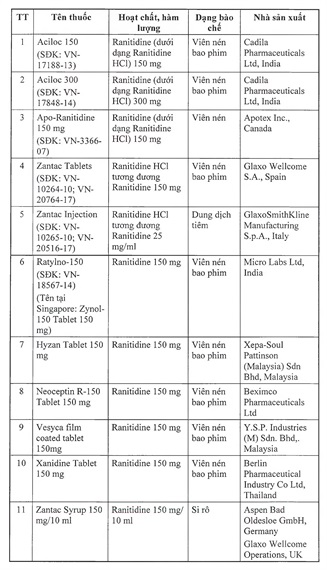 |
11 loại thuốc bị Cục Quản lý Dược thu hồi có hàm lượng Ranitidine 150 mg/10ml, 150 mg/25 ml và 150 mg, xuất xứ từ Ấn Độ, Tây Ban Nha, Italy, Anh, Thái Lan, Malaysia.
Cụ thể là Aciloc 150 mg, Aciloc 300 mg, Apro-Ranitidine 150 mg, Zantac Tablets, Zantac Injection, Ratylno-150, Hyzan Tablet 150 mg, Neoceptin R-150 Tablet 150 mg, Vesyca film coated tablet 150 mg, Xanidine Tablet 150 mg, Zantac Syrup 150 mg/10 ml. Đây là những loại thuốc có xuất xứ từ Ấn Độ, Canada, Tây Ban Nha, Ý, Malaysia, Thái Lan, Anh.
Bên cạnh đó, Cục quản lý Dược cũng yêu cầu Viện kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc TP.HCM tăng cường lấy mẫu để kiểm tra chất lượng nguyên liệu và thuốc chứa dược chất Ranitidine tại các cơ sở nhập khẩu và cơ sở sản xuất thuốc.
Trước đó, Cơ quan Khoa học Y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) cũng đã thu hồi 11 loại thuốc nói trên.